近日,放射医学协同创新中心郭正清教授与药学院何慧教授合作,成功开发出一种多功能光动力纳米酶。该材料通过氧调节机制、活性氧(ROS)放大效应及铁死亡诱导级联策略,显著提升乳腺癌放疗敏感性,为克服放疗抵抗提供了新途径。相关研究成果以“Multi-Enzymatic Cascade Catalysis in Photodynamic Nanozymes for Augmenting Radiotherapy of Breast Cancer”为题在线发表于Advanced Healthcare Material杂志上。
论文链接:http://doi.org/10.1002/adhm.202502530。
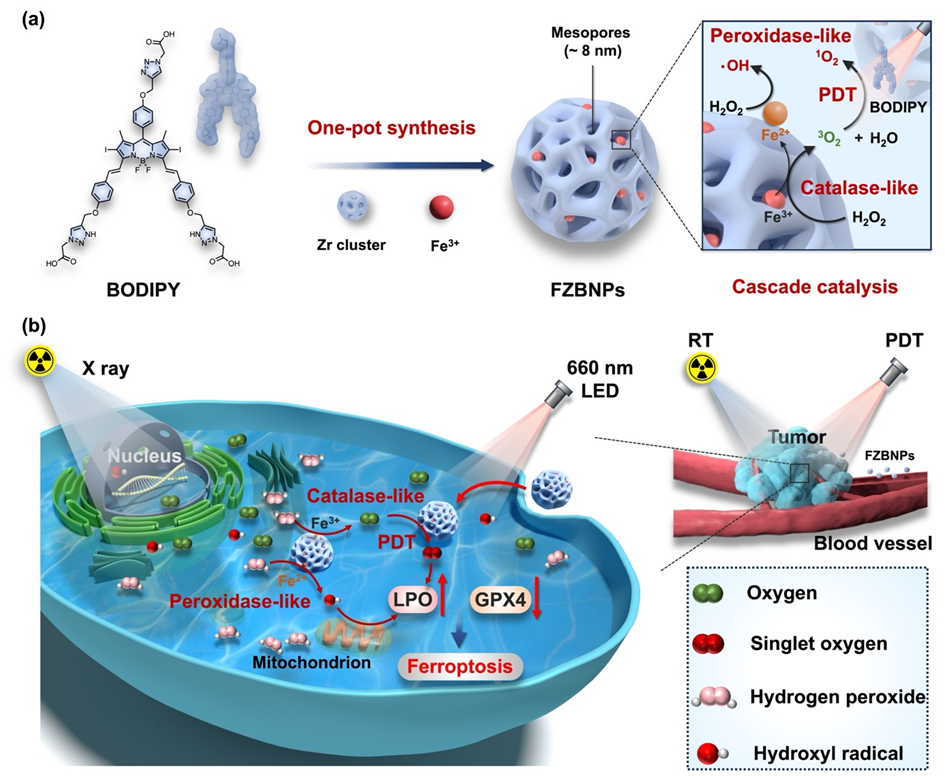
乳腺癌是全球女性癌症死亡主要病因之一,其中约60%的局部晚期乳腺癌患者需接受放疗(RT)。然而,肿瘤组织乏氧微环境、异常激活的抗氧化防御机制及DNA修复能力等多重因素导致放疗抵抗现象普遍存在。传统放疗剂量提升方案易引发正常组织毒性,亟需开发精准放疗增敏策略。纳米酶技术通过精准设计催化级联反应,可有效调控肿瘤微环境。近年来,层级多酶复合体系模拟天然生物催化过程成为前沿热点。例如,利用类过氧化氢酶(Catalase-like)活性分解肿瘤内源性过氧化氢(H₂O₂)产生氧气(O₂),进而通过类芬顿反应生成高毒性活性氧(ROS),形成自供氧级联催化循环系统。该策略既可显著改善肿瘤乏氧病灶,又能诱导强效氧化损伤,进而实现放疗增敏协同效应。
本研究基于上述背景,采用一步配位法构建了光动力纳米酶FZBNPs,其整合了类氧化氢酶、类过氧化物酶与类超氧化物歧化酶的三重仿生活性,形成多酶级联催化体系。其机制包括:1)催化分解内源性H₂O₂实现持续自供氧,解除肿瘤乏氧限制;2)高效生成羟基自由基(×OH),显著提升氧化杀伤能力;3)调控超氧阴离子(O₂-)与H₂O₂的动态平衡,避免O₂过度消耗。该体系进一步整合BODIPY光敏剂实施光动力治疗(PDT),在缺氧条件下仍能高效生成ROS。通过协同破坏氧化还原稳态与激活铁死亡信号通路,实现对放疗的双重增敏效应。实验证实,光动力纳米酶FZBNPs可协同优化PDT效率,突破传统单一疗法的局限性,为临床开发低剂量、高精准放疗策略提供了创新解决方案。
该研究工作由硕士研究生崔国庆、博士研究生路孜瑶和硕士研究生施江南为共同第一作者完成,何慧教授和郭正清教授为共同通讯作者。本研究得到国家自然科学基金,苏州市基础研究计划,大连理工大学精细化工国家重点实验室开放课题,江苏省高校放射损伤与修复重点实验室项目,江苏高校优势学科建设工程(PAPD)项目的资助。
(撰稿人路孜瑶、第一审稿人郭正清、第二审稿人王成奎,第一校稿人何慧、第二校稿人郭正清、第三校稿人徐加英)